Спирты
Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось название — алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким ученым Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Спирты (алкоголи) – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH)m, m≥1, где R – УВ радикал; m – число функциональных гидроксильных групп – ОН, которое определяет атомность спирта.
Классификация спиртов по строению УВ радикала:
Классификация спиртов по атомности:
Предельные одноатомные спирты (алканолы)
Общая формула: CnH2n+1OH, n≥1
Гомологический ряд

Изомерия и номенклатура
Первые два члена гомологического ряда – СН3ОН и С2Н5ОН – не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
— изомерия цепи (углеродного скелета);
— изомерия положения функциональной группы – ОН.

Спирты изомерны другому классу соединений – простым эфирам (R-O-R):

Электронное строение
Атомы углерода в алканолах находятся в состоянии sp 3 -гибридизации. Молекулы алканолов представляют собой диполи. Они содержат полярные связи С—Н, С—О, О—Н. Дипольные моменты связей С → О и О ←Н направлены в сторону атома кислорода, поэтому атом «О» имеет частичный отрицательный заряд δ — , а атомы «С» и «Н» — частичные положительные заряды δ + . Полярность связи О—Н больше полярности связи С—О вследствие большей разности электроотрицательностей кислорода и водорода. Однако полярность и этой связи недостаточна для диссоциации ее с образованием ионов Н + . Поэтому спирты являются неэлектролитами.
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностъю (О, N, F, Сl) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои неподеленные электронные пары, тем легче образуется водородная связь (ВС) и тем она прочнее.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О-Н, С-О, С-Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I.Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О-Н.
а) Взаимодействие с активными металлами с образованием алкоголятов металлов:
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются:
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации):
2. Замещение гидроксильной группы вследствие разрыва связи С-О.
а) Взаимодействие с галогеноводородами с образованием галогеналканов:
Следует отметить, что спирты можно превратить в галогенпроизводные действием и других реагентов, например хлоридов фосфора:
R – OH + PCl5 → R – Cl + POCl3 + HCl
б) Взаимодействие с аммиаком с образованием аминов.
Реакции идут при пропускании смеси паров спирта с аммиаком при 300 o С над оксидом алюминия:
При избытке спирта алкильными радикалами могут замещаться 2 или 3 атома водорода в молекуле NН3:
II. Реакции отщепления
1.Дегидратация, т.е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолектлярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—O—R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:

Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
2.Дегидрирование (разрыв связей О – Н и С – Н)
а) При дегидрировании первичных спиртов образуются альдегиды:
В организме человека этот процесс происходит под действием фермента (алкогольдегидрогеназы).
б) При дегидрировании вторичных спиртов образуются кетоны:
в) Третичные спирты не дегидрируются.
III. Реакции окисления
1.Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла:
2.Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:
Способы получения алканолов
Кроме прямой гидратации этилена, существует также сернокислотная гидратация, протекающая в две стадии:
— на первой стадии этилен поглощается серной кислотой:
— на второй стадии этилсерная кислота гидролизуется с образованием этилового спирта и серной кислоты:
При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:
2.Гидролиз галогеналканов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой —ОН:
Обратите внимание, что при действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена (см. способы получения алкенов).
3. Гидрирование альдегидов и кетонов
Как уже было отмечено выше, дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция — гидрирование альдегидов и кетонов — является, таким образом, их восстановлением.
В присутствии катализаторов (Ni, Pt, Pd, Со) альдегиды восстанавливаются до первичных спиртов, а кетоны — до вторичных спиртов:
4.Специфические методы получения метанола и этанола
Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:
Предельные многоатомные спирты
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта – глицерина, или пропантриола-1,2,3:

Физические свойства
Глицерин – вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с t о кип.=230 о С. Смешивается с водой во всех отношениях.
Химические свойства
I. Замещение атомов водорода гидроксильных групп
1.Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты:
2.Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu(OH)2. Продуктами этих реакций являются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме←О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме ←О за счет неподеленных электронных пар атомов кислорода других ОН-групп:
Нерастворимый в воде Cu(OH)2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). Эта реакция является качественной реакцией на все многоатомные спирты.
3.Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров:
II. Замещение гидроксильных групп
Наиболее известными реакциями этого типа является взаимодействие многоатомных спиртов с галогеноводородами. Например, при взаимодействии глицерина с хлороводородом ОН-группы последовательно замещаются атомами хлора:
Способы получения глицерина
1.Гидролиз жиров – основной способ получения глицерина:
2. Синтез из пропилена
В последнее время глицерин получают из пропилена. Существует несколько вариантов этого синтеза. По одному из них пропилен хлорируют при t o = 440—500 о С, полученный аллилхлорид гидролизуют раствором NaOH. На полученный в результате гидролиза аллиловый спирт действуют пероксидом водорода Н2О2, который в присутствии катализатора присоединяется к спирту по двойной связи с образованием глицерина. Весь процесс можно представить схемой:
Применение важнейших спиртов


В медицине С2Н5ОН применяется как дезинфицирующее средство и средство для компрессов, используется для приготовления экстрактов и настоек, как растворитель для многих лекарственных препаратов.
Скачать:
Скачать бесплатно реферат на тему: «Спирты» Спирты.docx (34 Загрузки)
Скачать бесплатно реферат на тему: «Синтез этилового спирта» Синтез-этилового-спирта.docx (33 Загрузки)
Скачать бесплатно реферат на тему: «Синтез метанола из оксида углерода и водорода» Синтез-метанола-из-оксида-углерода-и-водорода.docx (28 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
О сайте
Добро пожаловать на сайт! Здесь вы найдете самую полную информацию об истории химии и ее развитии как науки, а также интересные статьи о всех химических элементах известных на сегодняшний день и о соединениях, которые они образуют.
Формула спирта медицинского в химии
Классификация спиртов
Органические вещества,содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.
Существуют и полиатомные (многоатомные спирты),содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит)
Побочные действия вещества Этанол
Этиловый спирт
Прозрачная бесцветная подвижная, летучая жидкость с характерным спиртовым запахом и жгучим вкусом. Легко воспламеняется, горит синеватым бездымным пламенем. Смешивается во всех соотношениях с водой, глицерином, эфиром.
Изготовление настоек, экстрактов и лекарственных форм для наружного применения — обтираний, компрессов.
Угнетение ЦНС (резорбтивный эффект).

Для компрессов (во избежание ожога) этанол следует разбавить водой в соотношении 1:1.
| Название | Значение Индекса Вышковского ® |
| Спирт этиловый 95% | 0.0131 |
| Этиловый спирт | 0.0013 |
| Спирт этиловый | 0.0013 |
| Фармацевтический антисептический раствор для приготовления лекарственных форм | 0.0007 |
| Медицинский антисептический раствор | 0.0005 |
| Этанол медицинский | 0.0004 |
| Этиловый спирт 95% | 0.0003 |
| Медицинский антисептический раствор для приготовления лекарственных форм 95% | 0.0001 |
| Септол-Сол | |
| Этиловый спирт 96% |
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения.
Низшие и средние члены ряда предельных одноатомных спиртов,содержащих от 1 до 11 атомов углерода-жидкости.Высшие спирты(начиная с C12H25OH) при комнатной температуре-твердые вещества. Низшие спирты имеют алкогольный запах и жгучий вкус,они хорошо растворимы в воде.По мере увеличения углеродного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)
- Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
Данная реакция обратима. - Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир. - Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)
Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту,добавляют (родовой) суффикс-ол.

1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН. 2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан. 3. Число групп –ОН равно 2, префикс – «ди». 4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта: гептандиол-2,4
Меры предосторожности вещества Этанол
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy — вино, опьянеть; hule — вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды.
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.

Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) — вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану.
Этиловый спирт, он же этанол, он же винный спирт представляет собой бесцветную жидкость с характерным запахом и не менее своеобразным вкусом. Химическая формула спирта — C2H5OH, и получить это соединение можно двумя способами:
- гидратацией этилена (синтетический);
- брожением (микробиологический).
Первый способ достаточно сложен и редко используется даже в промышленных условиях, а дома так и вовсе не стоит отходить от использования натурального сырья. Мы ведь хотим получить качественный продукт, не правда ли?
Спиртовое брожение
Существует 2 основных способа получения этанола:
- микробиологический (спиртовое брожение);
- синтетический (гидратация этилена).
Синтетический путь получения этанола достаточно сложен, а в нашем случае ещё и мало интересен, так как наша задача получить качественный продукт исключительно из натурального сырья.
C6H12O6=
(12×6 1×12 16×6) = 2×(12×2 1×5 16 1) 2×(12 16×2)
Проще говоря, 180 кг сахара после реакции разложатся на 92 кг спирта и 88 кг углекислого газа. С учетом того, что плотность спирта составляет 0,8кг/л, можно подсчитать, что из килограмма сахара получается примерно 0.64 л спирта.
Сырье
Как известно, сырьем для получения спирта чаще всего служит не чистый сахар, а содержащие его продукты. Для того, чтобы рассчитать выход спирта при их брожении необходимо знать сахаристость, которая выражается в процентах. Например, сахаристость яблок 12%, а общая доля сока от массы плода достигает 70%.
(C6H10O5)n n×H2O катализатор = n×C6H12O6
Примечательно, что в данной реакции 1 кг крахмала преобразуется в 1.11 кг сахара, что и обеспечивает популярность именно такой технологии получения сахара. В остальном же расчет получаемого спирта крайне прост. Проведем его на примере пшеницы, содержащей 60% крахмала: из 1 кг зерен можно получить 600 гр крахмала, который после гидролиза преобразуется в 666 гр сахара, брожение которого позволит выделить 426 мг спирта.
Интересно, что в концентрированном растворе спирта дрожжи быстро погибают, поэтому на практике удается получать лишь 15% раствор. Именно таким образом получают известное всем вино, отсюда и название — винный спирт.
Стоит отметить, что на практике никогда не удается достигнуть теоретических значений, причем потери достигают 10. 15%. Эта ситуация объясняется особенностями протекания химической реакции, в процессе которой могут происходить следующие явления:
- Испарение спирта вместе углекислым газом.
- Вторичные реакции, в результате которых сахар превращается в побочные вещества.
- Неполное протекание основной реакции, в результате чего некоторая часть сахара остается в исходном состоянии.
Также часть драгоценной жидкости теряется во время очистки, которая осуществляется путем перегонки или ректификации. Это обязательное условие получение действительно качественного продукта, и избежать потерь во время очистки не удается даже при изготовлении вина.

Как видите, процесс получения спирта достаточно прост и вполне может быть осуществлен в домашних условиях. В промышленности технология производства несколько сложнее, но каких-то кардинальных отличий все равно нет, разве что на всех стадиях состояние смеси отслеживает электроника.
Книга знаний — уникальный сборник рецептов и научных исследований подготовленных экспертами нашей компании. Здесь вы найдете практические советы о домашнем и коммерческом производстве алкоголя и сыров от ведущих винокуров, пивоваров и сыроделов
Как делать водку на ректификационной колонне
Сколько сахара необходимо иметь в 1 литре сусла (водный раствор экстрактивных веществ растительного сырья или солода, предназначенный к сбраживанию)?
Наши магазины в МосквеОстаповский пр.,3; ул. Смольная 63Б/П8, Киевское шоссе дом 1, к. В, 204 Ярославское шоссе 146 к1
Этиловый спирт. Спирт этиловый медицинский – применение
Этиловый спирт можно узнать по запаху. Впрочем, отличить его таким образом можно лишь от весьма далеких по структуре веществ. Что же касается соединений одной с ним группы, все сложнее. Но это и интереснее.
Состав и формула
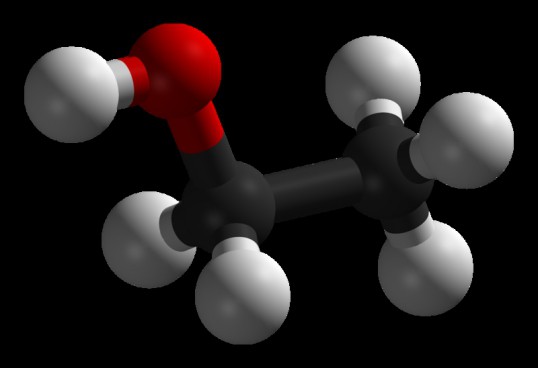
Этанол – а именно так звучит одно из его официальных названий – относится к простым спиртам. Он знаком практически всем под теми или иными наименованиями. Часто его называют просто спиртом, иногда прибавляют прилагательные “этиловый” или “винный”, химики могут также назвать его метилкарбинолом. Но суть одна – С2Н5ОН. Эта формула знакома, пожалуй, практически всем еще со школьных времен. И очень многие помнят, насколько это вещество подобно своему ближайшему родственнику – метанолу. Проблема лишь в том, что последний крайне токсичен. Но об этом позже, сначала стоит рассмотреть подробнее этанол.
Кстати, в химии есть много похожих терминов, так что не стоит путать этиловый спирт, например, с этиленом. Последний является бесцветным горючим газом и совсем не похож на прозрачную жидкость с характерным запахом. А еще есть газ этан, и его название тоже созвучно с наименованием “этанол”. Но это тоже совсем разные вещества.
Метиловый и этиловый
Уже долгие годы остается актуальной проблема массовых отравлений в связи с невозжностью отличить в домашних условиях два спирта. Контрафактный алкоголь, подпольное или просто некачественное производство – все это повышает риск плохой очистки и пренебрежения технологическими условиями.

Все это усложняется тем, что по своим основным свойствам метиловый и этиловый спирты – практически идентичные вещества, и неспециалист без нужного оборудования просто не сможет отличить один от другого. При этом смертельная доза метанола – 30 граммов, тогда как в случае с обычным спиртом такой объем совершенно безопасен для взрослого человека. Именно поэтому, если нет уверенности в происхождении напитка, лучше его не употреблять.
Что любопытно, антидотом для технического спирта является как раз чистый метанол. Так что, заметив признаки острого отравления, необходимо ввести раствор последнего внутривенно или принять перорально. Важно при этом не перепутать состояние интоксикации метанолом с обычным сильным алкогольным опьянением или отравлением. В этом случае, а также при отравлении некоторыми другими веществами ни в коем случае нельзя принимать дополнительно спирт этиловый. Цена ошибки может быть очень высокой.
Физические и химические свойства
Этанолу присущи все общие характеристики и реакции спиртов. Он бесцветный, обладает характерными вкусом и запахом. В нормальных условиях он жидкий, переходит в твердую форму при температуре -114 о С, а кипит при +78 градусах. Плотность спирта этилового составляет 0,79. Хорошо смешивается с водой, глицерином, бензолом и многими другими веществами. Легко улетучивается, так что хранить его нужно в хорошо закрывающихся емкостях. Сам является прекрасным растворителем, а также обладает отличными антисептическими свойствами. Очень огнеопасен как в жидком, так и в парообразном состоянии.
Этанол является психоактивным и наркотическим веществом, входит в состав всех спиртных напитков. Смертельной дозой для взрослого человека является 300-400 миллилитров 96 % раствора спирта, употребленного в течение часа. Эта цифра довольно условна, поскольку зависит от большого количества факторов. Для детей достаточно уже 6-30 миллилитров. Так что этанол является и достаточно эффективным ядом. Тем не менее, он широко используется, поскольку обладает рядом уникальных свойств, делающих его универсальным.
Разновидности
Существует несколько видов этилового спирта, используемых для разных целей. В основном они отражают способы получения вещества, но часто говорят и о различных методах обработки.
Так, надпись на упаковке “Спирт этиловый ректификованный” говорит о том, что содержимое прошло специальную очистку от примесей. Полностью очистить, например, от воды его довольно сложно, но можно максимально уменьшить ее присутствие.
Еще спирт может быть денатурированным. В этом случае все наоборот: к этанолу добавляют трудноустранимые примеси, делающие его непригодным для употребления внутрь, но не усложняющие применение по основному назначению. Как правило, в роли денатурата выступает керосин, ацетон, метанол и т. д.
Кроме того, различают спирт этиловый медицинский, технический, пищевой. Для каждой из этих разновидностей существует строгий стандарт, предусматривающий определенные критерии. Но о них поговорим чуть позже.
Кроме всего прочего, на упаковке часто указывается процент содержания. Это актуально, опять же, в связи с тем, что этанол сложно полностью очистить от воды, да и обычно в этом нет серьезной необходимости.

Получение
Производство этилового спирта предусматривает использование одного из трех основных способов: микробиологического, синтетического или гидролизного. В первом случае имеем дело с процессом брожения, во втором, как правило, задействуются химические реакции с применением ацетилена или этилена, ну а третий говорит сам за себя. Каждый из способов имеет свои плюсы и минусы, сложности и преимущества.
Для начала расмотрим этиловый спирт, который производится только для пищевых целей. Для его производства используется только метод брожения. В ходе этого процесса виноградный сахар распадается на этанол и двуокись углерода. Этот метод известен с глубокой древности и является наиболее естественным. Но он требует и большего количества времени. Кроме того, полученное вещество не является чистым спиртом и требует достаточного большого количества операций по обработке и очистке.
Для получения технического этанола брожение нецелесообразно, так что производители прибегают к одному из двух вариантов. Первый из них – сернокислая гидратация этилена. Она выполняется в несколько этапов, но есть и более простой метод. Второй вариант – прямая гидратация этилена в присутствии фосфорной кислоты. Эта реакция обратима. Впрочем, оба этих способа также несовершенны, и полученное вещество требует дальнейшей обработки.

Гидролиз – относительно новый метод, позволяющий получать этиловый спирт из древесины. Для этого сырье измельчается и обрабатывается 2-5 % серной кислотой при температуре 100-170 градусов по Цельсию. Этот метод позволяет получать до 200 литров этанола из 1 тонны древесины. По разным причинам гидролизный способ не слишком популярен в Европе, в отличие от США, где открывают все новые и новые заводы, работающие по этому принципу.
Стандарты
Весь этанол, который производится на предприятиях, должен соответствовать определенным стандартам. Для каждого способа получения и обработки есть свой, в котором указываются основные характеристики, которыми должен обладать конечный продукт. Рассматривается очень много свойств, например, содержание примесей, плотность спирта этилового, предназначение. Для каждой разновидности есть свой стандарт.
Так, например, синтетический технический спирт этиловый – ГОСТ Р 51999-2002 – делится на два сорта: первый и высший. Очевидное различие между ними – объемная доля этанола, которая составляет 96 % и 96,2 % соответственно. В стандарте под этим номером указывается как ректификованный, так и денатурированный этиловый спирт, предназначенный для использования в парфюмерной промышленности.

Для более прозаичной цели – применения в качестве растворителя – существует свой ГОСТ: Р 52574-2006. Здесь речь идет только о денатурате с разной объемной долей этанола – 92,5 % и 99 %.
Что же касается такого вида, как пищевой этиловый спирт, то для него действует ГОСТ Р 51652-2000, и у него есть целых 6 сортов: первый (96 %), высшей очистки (96,2 %), “Базис” (96 %), “Экстра” (96,3 %), “Люкс” (96,3 %) и “Альфа” (96,3 %). Здесь уже речь идет в первую очередь о сырье и некоторых других сложных показателях. Например, продукт марки “Альфа” вырабатывается только из пшеницы, ржи или их смеси.
До сих пор многие проводят, так сказать, параллели между двумя понятиями: спирт этиловый – ГОСТ 18300-87, который был принят еще в СССР. Этот стандарт давно утратил силу, что, однако, не мешает строить производство в соответствии с ним до сих пор.
Использование
Пожалуй, затруднительно найти вещество, которое имеет столь же широкое применение. Этиловый спирт так или иначе используется в очень многих отраслях производства.
Прежде всего, это пищевая промышленность. Самые разные алкогольные напитки – от вин и ликеров до виски, водки и коньяка – соджержат в своем составе упомянутый спирт. Но сам по себе в чистом виде этанол не используется. Технология предусматривает закладку сырья, например, виноградного сока и инициацию процесса брожения, а на выходе получается уже готовый продукт.
Еще одна область широкого применения – это медицина. Этиловый спирт 95 % в данном случае используется чаще всего, ведь он обладает прекрасными антисептическими свойствами, а также растворяет многие вещества, что позволяет с его помощью делать эффективные настойки, микстуры и прочие препараты. Кроме того, при разных видах наружного применения он способен как эффективно согревать, так и охлаждать организм. Нанеся его на кожу, можно быстро сбить высокую температуру тела на градус-полтора. И наоборот, энергичные растирания помогут согреться. Кроме того, при хранении анатомических препаратов также используется спирт этиловый медицинский.
Разумеется, еще одна область применения – это техника, химия и все, что с этим связано. Речь идет о лакокрасочных покрытиях, растворителях, очистителях и пр. Кроме того, этанол используется в промышленном производстве многих веществ или является сырьем для них (диэтиловый эфир, тетраэтилсвинен, уксусная кислота, хлороформ, этилен, каучук и многие другие). Спирт этиловый технический, естественно, совершенно непригоден в пищу, даже если он очищен.
Разумеется, во всех этих случаях речь идет о совершенно разные разновидности, каждая из которых имеет свои особенности. Так, пищевой спирт этиловый ректификованный вряд ли будут использовать для технических целей, тем более, что он облагается акцизом, а значит, его стоимость гораздо выше по сравнению с неочищенным. Впрочем, о ценообразовании речь пойдет отдельно.

Применение в новых технологиях
Все чаще в последние годы говорят об использовании этанола в качестве топлива. Этот подход имеет своих противников и сторонников, особенно часто речь об этом заходит в США. Дело в том, что американские фермеры традиционно выращивают много кукурузы, которая теоретически может служить прекрасным сырьем для того, чтобы получить спирт этиловый. Цена такого топлива однозначно будет ниже стоимости бензина. Этот вариант снимает вопрос зависимости многих стран от поставок нефти и цен на энергоносители, ведь производство спирта может располагаться где угодно. Кроме того, это безопаснее с точки зрения экологии. Впрочем, уже сейчас можно заметить использование этанола в этом качестве, но в гораздо меньших масштабах. Это спиртовки – специальные химические нагреватели, домашние мини-камины, а также многие другие приборы.
Это может быть действительно перспективным направлением работы в поисках альтернативных, возобновляемых и достаточно дешевых источников энергии. Проблема для России здесь состоит в менталитете. Достаточно сказать, что спиртовые фонари в Москве продержались недолго – работники, которые занимались их работой, просто выпивали сырье. И даже если топливо будет содержать различные примеси, совсем избежать отравлений вряд ли удастся. Впрочем, для РФ есть и другие поводы не стремиться к таким изменениям, поскольку переход на такой вид энергии грозит для страны серьезным снижением объема экспорта энергоносителей.
Действие на человеческий организм
В классификации СанПин этанол относится к 4 классу, то есть малоопасным веществам. Сюда же, кстати, относятся керосин, аммиак, метан и некоторые другие элементы. Но это не значит, что не стоит относиться к алкоголю несерьезно.
Этиловый спирт при употреблении внутрьсерьезно влияет на центральную нервную систему всех животных. Он вызывает состояние, называемое алкогольным опьянением, характеризующееся неадекватным поведением, заторможенностью реакций, снижением восприимчивости к различного рода раздражителям и т. д. При этом все сосуды расширяются, увеличивается теплоотдача, учащается сердцебиение и дыхание. В состоянии небольшого опьянения ясно видно характерное возбуждение, при повышении дозы сменяющееся угнетением центральной нервной системы. Как правило, после этого появляется сонливость.

В более высоких дозах может наступить алкогольная интоксикация, серьезно отличающая от картины, описанной ранее. Дело в том, что этанол является наркотическим веществом, но не используется в этом качестве, поскольку для эффективного усыпления нужны дозы, крайне близкие к тем, при которым наступает паралич жизненно важных центров. Состояние алкогольной интоксикации – как раз та грань, когда без оказания экстренной помощи человек может умереть, поэтому так важно отличать это от опьянения. При этом наблюдается что-то вроде комы, дыхание редкое и пахнет спиртом, пульс учащенный, кожа бледная и влажная, температура тела понижена. Необходимо немедленно обратиться за медицинской помощью, а также попробовать промыть желудок.
Регулярное употребление этанола может вызвать пагубное пристрастие – алкоголизм. Оно характеризуется изменением и деградацией личности, также страдают различные системы органов, прежде всего это касается печени. Существует даже характерное для алкоголиков “со стажем” заболевание – цирроз. В некоторых случаях оно даже приводит к необходимости пересадки.
Что касается наружного применения, этиловый спирт раздражает кожу, одновременно являясь эффективным антисептиком. Он также уплотняет эпидермис, поэтому его используют для обработки пролежней и других повреждений.
Реализация и ее особенности
Стандарты – это не единственное, с чем имеют дело те, кто производят спирт этиловый. Цена на разные сорта, марки и разновидности очень разнится. И это неспроста, ведь то, что предназначего для употребления в пищу – подакцизный товар. Обложение этим дополнительным налогом делает стоимость соответствующего ректификата заметно выше. Это позволяет в известной степени контролировать оборот спирта этилового в продаже, а также стоимость алкогольной продукции.
Кстати, это еще и вещество, подлежащее строгому учету. Поскольку этанол используется при производстве лекарств, медицинских манипуляциях и т. д., он в той или иной форме хранится в аптеках, больницах, поликлиниках и прочих учреждениях. Впрочем, это не означает, что устроившись на работу по соответствующей специальности, можно легко и незаметно получить в пользование хоть какое-то количество вещества. Учет этилового спирта производится с помощью специального журнала, а нарушение процедур является административным правонарушением и наказывается штрафом. Что пропажу заметят в самые короткие сроки.
Спирты
Спирты – кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда – метанол – CH3OH. Общая формула их гомологического ряда – CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH – гликоли), трехатомными (3 группы OH – глицерины) и т.д.

Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).

Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса “ол” к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.

Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.

Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПиртовым раствором щелочи получаются Пи-связи (π-связи) – алкены, а в реакциях с водным раствором щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.

В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.

Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.

В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы – образуется двухатомный спирт (гликоль).

Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии – кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.

В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный – образуются алкены.
Названия простых эфиров формируются проще простого – по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир – CH3-O-CH3
- Метилэтиловый эфир – CH3-O-C2H5
- Диэтиловый эфир – C2H5-O-C2H5

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.

Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.

Первичные спирты окисляются до альдегидов, а вторичные – до кетонов. Альдегиды могут быть окислены далее – до карбоновых кислот, в отличие от кетонов, которые являются “тупиковой ветвью развития” и могут снова стать вторичными спиртами.

Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.

Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Межклассовыми изомерами предельных одноатомных спиртов являются простые эфиры.
Спирт можно получить реакцией щелочи с галогеналканом в водном растворе.
При внутримолекулярной дегидратации из спиртов образуются алкены.
При нагревании спиртов до 140° преимущественно происходит образование простых эфиров.
Качественная реакция на многоатомные спирты – реакция со свежеприготовленным гидроксидом меди II.
Формула этилового спирта в химии. Химическое использование спирта
Благодаря истории, мы можем узнать многие подробности, касающиеся, нашей обыденной жизни. Давайте обратимся к истокам и выясним кто же впервые открыл формулу этила.
Во многих частях земли химическая формула этилового спирта, была открыта почти в одно время. Кто изобрёл этил, а также этиловый спирт и формулу? Французский алхимик Арно де Вильггер в 1334 году открыл винный спирт. А также было вещество имеющее название «Вода жизни» которую изобрели итальянские и французские монахи в 1360 году.
Также не стоит забывать о том, что в Москву, впервые, этил привезли генуэзские торговцы в 1386 году, дабы продемонстрировать его сильные стороны. Они, конечно, не могли знать, что через несколько столетий, в России введут так называемый Сухой закон.
Вполне вероятно что закон на запрет продажи и употребления алкоголя привнёс много положительных моментов в жизнь тогдашних людей. Хотя бы такие моменты, как уменьшение преступлений, психически нездоровых людей, повышение рождаемости здоровых детей, и увеличение рождаемости в целом, также уменьшилось число самоубийц. Конечно, в самом запрете были и минусы: алкоголь изготовляли тайно – нарушение закона, плюс ко всему ещё и отравление при употреблении суррогатов. Хотелось бы отметить, по моему мнению, полный запрет излишен, но должен быть какой-то предел продажи или подобное этому, необходимо ограничение. А употреблять или нет, это уже вопрос, на который должен ответить каждый себе лично.

Виды спирта
Существует несколько основных видов:
- этиловый (винный);
- метиловый (древесный);
- пентан-1-ол (амиловый);
- гексадекан-1-ол (цетиловый).
Из видео вы узнаете о спиртах и их химических свойствах.
Что же такое этил?
В химии это довольно сложное и запутанное определение, но все же я его помещу сюда, чтобы вы понимали о чём здесь идёт речь.
Спирты – органические вещества, которые содержат одну или несколько гидроксильных групп, непосредственно связанных с атомом углерода, находится в состоянии -гибридизации (насыщенный атом углерода).
Что же такое этиловый спирт?
Этанол (он же этил также известен как винный спирт, мы привыкли считать его просто алкоголем) – одноатомный спирт с очень знакомой нам химической формулой С2Н5ОН. В обычных условиях летучая, не имеющая цвета, легковоспламеняющаяся жидкость. Психоактивное вещество, которое угнетает центральную нервную систему (ЦНС), а также входит в состав алкогольных напитков. Алкоголь вошёл в нашу жизнь уже довольно давно и стал неотъемлемой частью любого праздничного застолья. Употреблять алкоголь или нет, этот спор может затянуться на долгие часы, а то и привести к печальным последствиям. На самом же деле каждый сам вправе и должен решить «пить или не пить, вот в чём вопрос».

В далёком 1880 году, всем известный Генри Форд, изобрёл автомобиль при этом в качестве топлива использовав этанол. В 1902 году также была представлена возможность использования этанола как топливо для автомобилей. Тогда на конкурсе было показано около 70 двигателей которые работали на этаноле и его смеси с бензином, в качестве смешивания топлива использовался карбюратор.
Номенклатура, классификация, изометрия спиртов.
Применение
- В химической промышленности применение этанола, безусловно, весьма широко. Вот некоторые из применений: используется как растворитель (бытовая химия, лакокрасочные изделия); входит в состав антифризов и жидкостей для омывания стёкол; применяется в моющих средствах, и это только немногие применения этанола.
- Спирт применяется в медицине, прежде всего как антисептик. Растворитель всевозможных лекарств. В медицине применение спирта очень важная составляющая и нельзя недооценивать важность этила.
- Используется в парфюмерии как основной компонент духов, одеколонов и аэрозолей. Входит в состав зубных паст, различных шампуней, гелей для душа и т. п.
Бесспорно, необходимо отдать должное Арно де Вильггер, а также другим алхимикам, за то, что они изобрели формулу этила. Применение этила является важнейшим аспектом как в медицине, так и в парфюмерии как производстве, так и в химии. С2Н5ОН – химическая формула спирта, известная практически каждому ещё со школьной скамьи, по крайне мере тем, кто хоть немного, слушал на уроках все, что связано со словом «химический».
Невозможно не затронуть такую тонкую тему вреда и пользы алкоголя. Как многие привыкли считать, алкоголь в небольших дозах полезен, но, к сожалению, доля пользы несопоставима с долей вреда который алкоголь приносит. Из пользы можно выделить незначительное предотвращение формирования тромбоза, что само по себе приводит к хорошему кровообращению. А вот из вредных аспектов выделим то, что алкоголь может внести изменение в генетическую структуру человека, может повлиять на отклонения у новорождённых детей, помимо этого, не стоит и говорить о том влиянии которое алкоголь оказывает на поведение человека.
Больше всего изнасилований и преступлений в целом было совершено в алкогольном опьянении, что в целом полностью говорит о пагубности употребления алкогольных напитков.
В конце статьи, хотелось бы подвести итог. Несомненно, польза этилового спирта неоспорима! Употребление алкоголя это немалый минус, с которым нужно бороться, но борьба начинается с нас самих.
Введение. Что мы знаем о спирте?
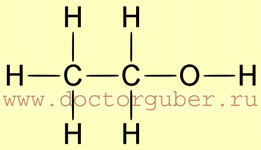 Этиловый спирт, он же этанол, он же винный спирт представляет собой бесцветную жидкость с характерным запахом и не менее своеобразным вкусом. Химическая формула спирта — C2H5OH, и получить это соединение можно двумя способами:
Этиловый спирт, он же этанол, он же винный спирт представляет собой бесцветную жидкость с характерным запахом и не менее своеобразным вкусом. Химическая формула спирта — C2H5OH, и получить это соединение можно двумя способами:
- гидратацией этилена (синтетический);
- брожением (микробиологический).
Первый способ достаточно сложен и редко используется даже в промышленных условиях, а дома так и вовсе не стоит отходить от использования натурального сырья. Мы ведь хотим получить качественный продукт, не правда ли?
Спиртовое брожение
Существует 2 основных способа получения этанола:
- микробиологический (спиртовое брожение);
- синтетический (гидратация этилена).
Синтетический путь получения этанола достаточно сложен, а в нашем случае ещё и мало интересен, так как наша задача получить качественный продукт исключительно из натурального сырья.
C6H12O6=> 2C2H5OH + 2CO2 + тепло
 Данная формула показывает, что одна молекула сахара под действием дрожжевых клеток разлагается на две молекулы этилового спирта и такое же количество молекул углекислого газа, а показателем успешно проходящей реакции является выделение тепла. Однако количество молекул само по себе для наших целей не означает ровным счетом ничего, куда важнее — масса получаемых продуктов. Чтобы ее вычислить вспомним молярные массы участвующих в реакции веществ:
Данная формула показывает, что одна молекула сахара под действием дрожжевых клеток разлагается на две молекулы этилового спирта и такое же количество молекул углекислого газа, а показателем успешно проходящей реакции является выделение тепла. Однако количество молекул само по себе для наших целей не означает ровным счетом ничего, куда важнее — масса получаемых продуктов. Чтобы ее вычислить вспомним молярные массы участвующих в реакции веществ:
С учетом этого приведенное выше равенство в формате масс будет выглядеть следующим образом:
(12×6+1×12+16×6) = 2×(12×2+1×5+16+1)+2×(12+ 16×2)
Проще говоря, 180 кг сахара после реакции разложатся на 92 кг спирта и 88 кг углекислого газа. С учетом того, что плотность спирта составляет 0,8кг/л, можно подсчитать, что из килограмма сахара получается примерно 0.64 л спирта.
Сырье
Как известно, сырьем для получения спирта чаще всего служит не чистый сахар, а содержащие его продукты. Для того, чтобы рассчитать выход спирта при их брожении необходимо знать сахаристость, которая выражается в процентах. Например, сахаристость яблок 12%, а общая доля сока от массы плода достигает 70%. Это означает, что 1 кг яблок позволит получить 700 гр сока, из него, соответственно, возможно получение 84 гр сахара, брожение которого даст 54 мл спирта.
Нередко сырьем для спирта служит крахмалосодержащее сырье. В таком случае технологическая цепочка должна включать процесс гидролиза (превращения) крахмала в сахар под воздействием катализирующих ферментов:
(C6H10O5)n + n×H2O + катализатор = n×C6H12O6
 Примечательно, что в данной реакции 1 кг крахмала преобразуется в 1.11 кг сахара, что и обеспечивает популярность именно такой технологии получения сахара. В остальном же расчет получаемого спирта крайне прост. Проведем его на примере пшеницы, содержащей 60% крахмала: из 1 кг зерен можно получить 600 гр крахмала, который после гидролиза преобразуется в 666 гр сахара, брожение которого позволит выделить 426 мг спирта.
Примечательно, что в данной реакции 1 кг крахмала преобразуется в 1.11 кг сахара, что и обеспечивает популярность именно такой технологии получения сахара. В остальном же расчет получаемого спирта крайне прост. Проведем его на примере пшеницы, содержащей 60% крахмала: из 1 кг зерен можно получить 600 гр крахмала, который после гидролиза преобразуется в 666 гр сахара, брожение которого позволит выделить 426 мг спирта.
Интересно, что в концентрированном растворе спирта дрожжи быстро погибают, поэтому на практике удается получать лишь 15% раствор. Именно таким образом получают известное всем вино, отсюда и название — винный спирт.
Стоит отметить, что на практике никогда не удается достигнуть теоретических значений, причем потери достигают 10. 15%. Эта ситуация объясняется особенностями протекания химической реакции, в процессе которой могут происходить следующие явления:
- Испарение спирта вместе углекислым газом.
- Вторичные реакции, в результате которых сахар превращается в побочные вещества.
- Неполное протекание основной реакции, в результате чего некоторая часть сахара остается в исходном состоянии.
Также часть драгоценной жидкости теряется во время очистки, которая осуществляется путем перегонки или ректификации. Это обязательное условие получение действительно качественного продукта, и избежать потерь во время очистки не удается даже при изготовлении вина.
Как видите, процесс получения спирта достаточно прост и вполне может быть осуществлен в домашних условиях. В промышленности технология производства несколько сложнее, но каких-то кардинальных отличий все равно нет, разве что на всех стадиях состояние смеси отслеживает электроника.
Книга знаний — уникальный сборник рецептов и научных исследований подготовленных экспертами нашей компании. Здесь вы найдете практические советы о домашнем и коммерческом производстве алкоголя и сыров от ведущих винокуров, пивоваров и сыроделов
Как делать водку на ректификационной колонне

Сколько сахара необходимо иметь в 1 литре сусла (водный раствор экстрактивных веществ растительного сырья или солода, предназначенный к сбраживанию)?
Наши магазины в Москве
Остаповский пр.,3;
ул. Смольная 63Б/П8,
Киевское шоссе дом 1, к. В, 204
Ярославское шоссе 146 к1
© Doctor Guber 2007—2020
Подписывайтесь на новости Doctor Guber
1. Предоставление информации Клиентом:
1.1. При регистрации на сайте doctorguber.ru (далее — «Сайт») Клиент предоставляет следующую информацию: фамилия, имя, адрес электронной почты. При оформлении заказа на сайте Клиент предоставляет Продавцу информацию: фамилия, имя, отчество, телефон, адрес электронной почты, город и адрес доставки. При заказе обратного звонка на сайте Продавца клиент предоставляет: телефон, город проживания. При записи на обучающие семинары через сайт Клиент предоставляет Продавцу информацию: фамилия, имя, отчество, телефон, адрес электронной почты, город.
1.2. Предоставляя свои персональные данные Клиент соглашается на их обработку (вплоть до отзыва Клиентом своего согласия на обработку его персональных данных) компаниями ООО «ТД Доктор Губер» расположенному по адресу: 191002, Достоевского 24/9А, 3Н и ООО «ТДДГ Розница» расположенному по адресу: 190068 г. Санкт-Петербург, пр-кт Римского-Корсакова, дом 3, корпус лит.А, кв. пом 19Н (далее — «Продавец»), в целях исполнения Продавцом и/или его партнерами своих обязательств перед клиентом, продажи товаров и предоставления услуг, предоставления справочной информации, а также в целях продвижения товаров, работ и услуг, а также соглашается на получение сообщений рекламно-информационного характера и сервисных сообщений. При обработке персональных данных Клиента Продавец руководствуется Федеральным законом «О персональных данных», Федеральным законом «О рекламе» и локальными нормативными документами.
1.2.1. Если Клиент желает уточнения его персональных данных, их блокирования или уничтожения в случае, если персональные данные являются неполными, устаревшими, неточными, незаконно полученными или не являются необходимыми для заявленной цели обработки, либо в случае желания клиента отозвать свое согласие на обработку персональных данных или устранения неправомерных действий Продавцом и/или его партнерами в отношении его персональных данных, то он должен направить письменное требование на электронный адрес продавца. Адрес электронной почты: info@doctorguber.ru
Если Клиент желает удалить свою учетную запись на Сайте, Клиент обращается к нам по адресу info@doctorguber.ru с соответствующей просьбой. Данное действие не подразумевает отзыв согласия Клиента на обработку его персональных данных, который согласно действующему законодательству происходит в порядке, предусмотренном абзацем 1 настоящего пункта.
1.3. Использование информации предоставленной Клиентом и получаемой Продавцом.
1.3.1 Продавец использует предоставленные Клиентом данные в течение всего срока регистрации Клиента на Сайте в целях:
- регистрации/авторизации Клиента на Сайте;
- обработки Заказов Клиента и для выполнения своих обязательств перед Клиентом;
- для осуществления деятельности по продвижению товаров и услуг;
- оценки и анализа работы Сайта;
- определения победителя в акциях, проводимых Продавцом;
- анализа покупательских особенностей Клиента и предоставления персональных рекомендаций;
- участия Клиента в программах лояльности;
- информирования клиента о новых статьях, новостях, акциях, скидках и специальных предложениях посредством электронных и СМС-рассылок.
1.3.2. Продавец вправе направлять Клиенту сообщения рекламно-информационного характера. Если Клиент не желает получать сообщения рекламно-информационного характера от Продавца, он должен изменить соответствующие настройки, ссылка на которые содержится в отправляем клиенту письме или обратиться с соответствующей просьбой по адресу info@doctorguber.ru. С момента изменения указанных настроек получение рассылок Продавца возможно в течение 3 дней, что обусловлено особенностями работы и взаимодействия информационных систем, а так же условиями договоров с контрагентами, осуществляющими в интересах Продавца рассылки сообщений рекламно-информационного характера. Отказ Клиента от получения сервисных сообщений невозможен по техническим причинам. Сервисными сообщениями являются направляемые на адрес электронной почты, указанный при регистрации на Сайте, а также посредством смс-сообщений и/или push-уведомлений и через Службу по работе с клиентами на номер телефона, указанный при регистрации и/или при оформлении Заказа, о состоянии Заказа, товарах в корзине Клиента.
2. Предоставление и передача информации, полученной Продавцом:
2.1. Продавец обязуется не передавать полученную от Клиента информацию третьим лицам. Не считается нарушением предоставление Продавцом информации агентам и третьим лицам, действующим на основании договора с Продавцом, для исполнения обязательств перед Клиентом и только в рамках договоров. Не считается нарушением настоящего пункта передача Продавцом третьим лицам данных о Клиенте в обезличенной форме в целях оценки и анализа работы Сайта, анализа покупательских особенностей Клиента и предоставления персональных рекомендаций.
2.2. Не считается нарушением обязательств передача информации в соответствии с обоснованными и применимыми требованиями законодательства Российской Федерации.
2.3. Продавец вправе использовать технологию «cookies». «Cookies» не содержат конфиденциальную информацию и не передаются третьим лицам.
2.4. Продавец получает информацию об ip-адресе посетителя Сайта doctorguber.ru и сведения о том, по ссылке с какого интернет-сайта посетитель пришел. Данная информация не используется для установления личности посетителя.
2.5. Продавец не несет ответственности за сведения, предоставленные Клиентом на Сайте в общедоступной форме.
2.6. Продавец при обработке персональных данных принимает необходимые и достаточные организационные и технические меры для защиты персональных данных от неправомерного доступа к ним, а также от иных неправомерных действий в отношении персональных данных.
3. Хранение и использование информации Клиентом
3.1. Клиент обязуется не сообщать третьим лицам логин и пароль, используемые им для идентификации на сайте doctorguber.ru .
3.2. Клиент обязуется обеспечить должную осмотрительность при хранении и использовании логина и пароля (в том числе, но не ограничиваясь: использовать лицензионные антивирусные программы, использовать сложные буквенно-цифровые сочетания при создании пароля, немедленно изменить пароль после автоматической регистрации, уведомление о котором поступает на электронную почту клиента, не предоставлять в распоряжение третьих лиц компьютер или иное оборудование с введенными на нем логином и паролем Клиента)
3.3. В случае возникновения у Продавца подозрений относительно использования учетной записи Клиента третьим лицом или вредоносным программным обеспечением Продавец вправе в одностороннем порядке изменить пароль Клиента.






