Спирты
Формула винного, или этилового, спирта (этанола) С2Н5ОН, несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий — aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества — spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось название — алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловицем и немецким ученым Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашёную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
Спирты (алкоголи) – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH)m, m≥1, где R – УВ радикал; m – число функциональных гидроксильных групп – ОН, которое определяет атомность спирта.
Классификация спиртов по строению УВ радикала:
Классификация спиртов по атомности:
Предельные одноатомные спирты (алканолы)
Общая формула: CnH2n+1OH, n≥1
Гомологический ряд

Изомерия и номенклатура
Первые два члена гомологического ряда – СН3ОН и С2Н5ОН – не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
— изомерия цепи (углеродного скелета);
— изомерия положения функциональной группы – ОН.

Спирты изомерны другому классу соединений – простым эфирам (R-O-R):

Электронное строение
Атомы углерода в алканолах находятся в состоянии sp 3 -гибридизации. Молекулы алканолов представляют собой диполи. Они содержат полярные связи С—Н, С—О, О—Н. Дипольные моменты связей С → О и О ←Н направлены в сторону атома кислорода, поэтому атом «О» имеет частичный отрицательный заряд δ — , а атомы «С» и «Н» — частичные положительные заряды δ + . Полярность связи О—Н больше полярности связи С—О вследствие большей разности электроотрицательностей кислорода и водорода. Однако полярность и этой связи недостаточна для диссоциации ее с образованием ионов Н + . Поэтому спирты являются неэлектролитами.
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностъю (О, N, F, Сl) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои неподеленные электронные пары, тем легче образуется водородная связь (ВС) и тем она прочнее.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О-Н, С-О, С-Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
I.Реакции замещения
1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О-Н.
а) Взаимодействие с активными металлами с образованием алкоголятов металлов:
Эти реакции протекают только в безводной среде; в присутствии воды алкоголяты полностью гидролизуются:
б) Взаимодействие с органическими и неорганическими кислотами с образованием сложных эфиров (реакции этерификации):
2. Замещение гидроксильной группы вследствие разрыва связи С-О.
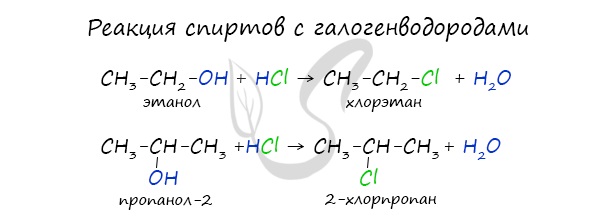
а) Взаимодействие с галогеноводородами с образованием галогеналканов:
Следует отметить, что спирты можно превратить в галогенпроизводные действием и других реагентов, например хлоридов фосфора:
R – OH + PCl5 → R – Cl + POCl3 + HCl
б) Взаимодействие с аммиаком с образованием аминов.
Реакции идут при пропускании смеси паров спирта с аммиаком при 300 o С над оксидом алюминия:
При избытке спирта алкильными радикалами могут замещаться 2 или 3 атома водорода в молекуле NН3:
II. Реакции отщепления
1.Дегидратация, т.е. отщепление воды
Дегидратация спиртов может быть двух типов: межмолектлярная и внутримолекулярная.
а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—O—R’. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:

Первый член гомологического ряда алканолов – метанол СН3ОН – не вступает в реакции внутримолекулярной дегидратации.
Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
2.Дегидрирование (разрыв связей О – Н и С – Н)
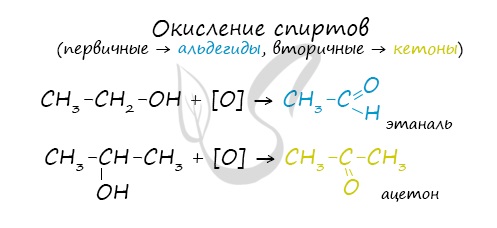
а) При дегидрировании первичных спиртов образуются альдегиды:
В организме человека этот процесс происходит под действием фермента (алкогольдегидрогеназы).
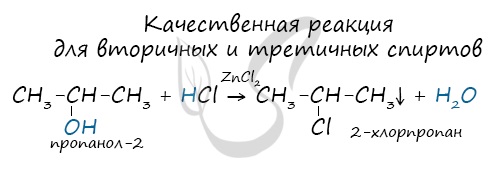
б) При дегидрировании вторичных спиртов образуются кетоны:
в) Третичные спирты не дегидрируются.
III. Реакции окисления
1.Горение (полное окисление)
Спирты горят на воздухе с выделением большого количества тепла:
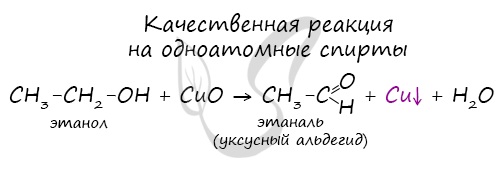
2.Неполное окисление под действием окислителей: кислорода воздуха в присутствии катализаторов (например, Cu), перманганата калия, дихромата калия и др.
Реакции неполного окисления спиртов по своим результатам аналогичны реакциям дегидрирования:
Способы получения алканолов
Кроме прямой гидратации этилена, существует также сернокислотная гидратация, протекающая в две стадии:
— на первой стадии этилен поглощается серной кислотой:
— на второй стадии этилсерная кислота гидролизуется с образованием этилового спирта и серной кислоты:
При гидратации гомологов этилена в соответствии с правилом Марковникова образуются вторичные или третичные спирты:
2.Гидролиз галогеналканов
При действии водного раствора NaOH атом галогена в галогеналкане замещается группой —ОН:
Обратите внимание, что при действии спиртового раствора щелочи на галогеналканы происходит отщепление галогеноводорода и образование алкена (см. способы получения алкенов).
3. Гидрирование альдегидов и кетонов
Как уже было отмечено выше, дегидрирование спиртов по своей химической сущности является окислением. Обратная реакция — гидрирование альдегидов и кетонов — является, таким образом, их восстановлением.
В присутствии катализаторов (Ni, Pt, Pd, Со) альдегиды восстанавливаются до первичных спиртов, а кетоны — до вторичных спиртов:
4.Специфические методы получения метанола и этанола
Этанол образуется при брожении (ферментации) углеводов – глюкозы или крахмала:
Предельные многоатомные спирты
Свойства многоатомных спиртов рассмотрим на примере простейшего трехатомного спирта – глицерина, или пропантриола-1,2,3:

Физические свойства
Глицерин – вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с t о кип.=230 о С. Смешивается с водой во всех отношениях.
Химические свойства
I. Замещение атомов водорода гидроксильных групп
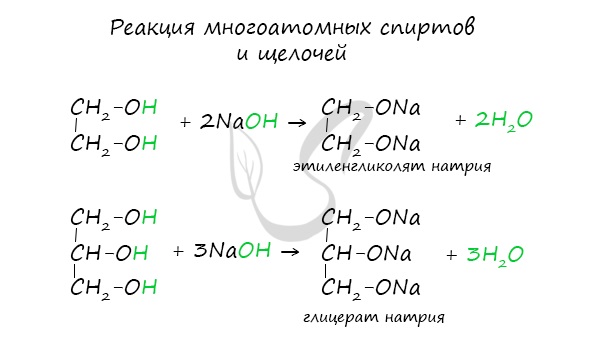
1.Как и одноатомные спирты, многоатомные спирты взаимодействуют со щелочными металлами; при этом могут образовываться моно-, ди- и тризамещенные продукты:
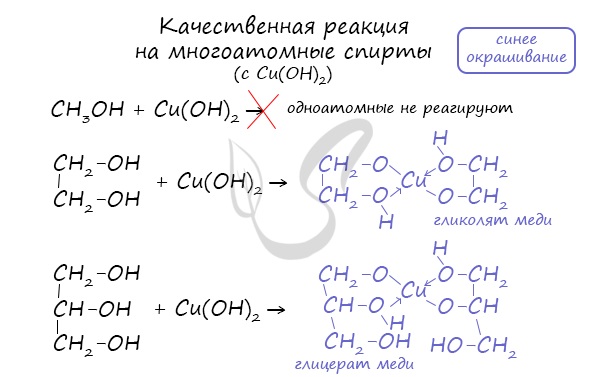
2.Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu(OH)2. Продуктами этих реакций являются внутрикомплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме←О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме ←О за счет неподеленных электронных пар атомов кислорода других ОН-групп:
Нерастворимый в воде Cu(OH)2 голубого цвета растворяется в глицерине с образованием ярко-синего раствора глицерата меди (II). Эта реакция является качественной реакцией на все многоатомные спирты.
3.Многоатомные спирты, как и одноатомные, взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров:
II. Замещение гидроксильных групп
Наиболее известными реакциями этого типа является взаимодействие многоатомных спиртов с галогеноводородами. Например, при взаимодействии глицерина с хлороводородом ОН-группы последовательно замещаются атомами хлора:
Способы получения глицерина
1.Гидролиз жиров – основной способ получения глицерина:
2. Синтез из пропилена
В последнее время глицерин получают из пропилена. Существует несколько вариантов этого синтеза. По одному из них пропилен хлорируют при t o = 440—500 о С, полученный аллилхлорид гидролизуют раствором NaOH. На полученный в результате гидролиза аллиловый спирт действуют пероксидом водорода Н2О2, который в присутствии катализатора присоединяется к спирту по двойной связи с образованием глицерина. Весь процесс можно представить схемой:
Применение важнейших спиртов


В медицине С2Н5ОН применяется как дезинфицирующее средство и средство для компрессов, используется для приготовления экстрактов и настоек, как растворитель для многих лекарственных препаратов.
Скачать:
Скачать бесплатно реферат на тему: «Спирты» Спирты.docx (34 Загрузки)
Скачать бесплатно реферат на тему: «Синтез этилового спирта» Синтез-этилового-спирта.docx (33 Загрузки)
Скачать бесплатно реферат на тему: «Синтез метанола из оксида углерода и водорода» Синтез-метанола-из-оксида-углерода-и-водорода.docx (28 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
О сайте
Добро пожаловать на сайт! Здесь вы найдете самую полную информацию об истории химии и ее развитии как науки, а также интересные статьи о всех химических элементах известных на сегодняшний день и о соединениях, которые они образуют.
Спирты — номенклатура, получение, химические свойства

Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
Классификация спиртов
По числу гидроксильных групп (атомности) спирты делятся на:
Одноатомные, например: 
Двухатомные (гликоли), например: 
Трехатомные, например: 
По характеру углеводородного радикала выделяют следующие спирты:
Предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например: 

Непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:

Ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:

Органические вещества,содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.

Существуют и полиатомные (многоатомные спирты),содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит)

Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту,добавляют (родовой) суффикс-ол.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-,тетра- и т.д.-их число:


В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:

Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам:

Давайте дадим название спирту, формула которого указана ниже:

Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.
2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан.
3. Число групп –ОН равно 2, префикс – «ди».
4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта: гептандиол-2,4
Физические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения.Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов-метанол,имея относительную молекулярную массу 32, в обычных условиях-жидкость.

Низшие и средние члены ряда предельных одноатомных спиртов,содержащих от 1 до 11 атомов углерода-жидкости.Высшие спирты(начиная с C12H25OH) при комнатной температуре-твердые вещества. Низшие спирты имеют алкогольный запах и жгучий вкус,они хорошо растворимы в воде.По мере увеличения углеродного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)

- Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
 Данная реакция обратима.
Данная реакция обратима. - Межмолекулярная дегидратацияспиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств:

В результате межмолекулярной дегидратации спиртов образуются простые эфиры.Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир.
- Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)

Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
- Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:

- Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
 При окислении вторичных спиртов образуются кетоны:
При окислении вторичных спиртов образуются кетоны: 
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе. - Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:


- Качественная реакция на многоатомные спирты.
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.

Получение спиртов:

Применение спиртов
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy — вино, опьянеть; hule — вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди (II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) — вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и, таким образом, придавая пластмассам необходимую гибкость и эластичность.
Спирты
Спирты – кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода.
Спирты также называют алкоголи. Первый член гомологического ряда – метанол – CH3OH. Общая формула их гомологического ряда – CnH2n+1OH.
Классификация спиртов
По числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH – гликоли), трехатомными (3 группы OH – глицерины) и т.д.
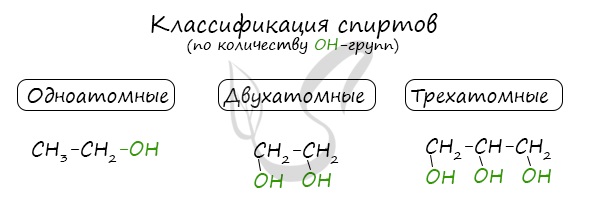
Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода).
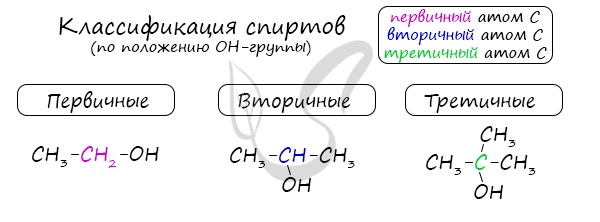
Номенклатура и изомерия спиртов
Названия спиртов формируются путем добавления суффикса “ол” к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д.
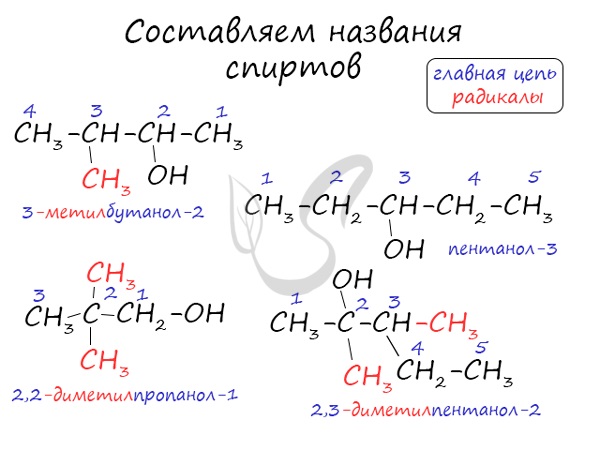
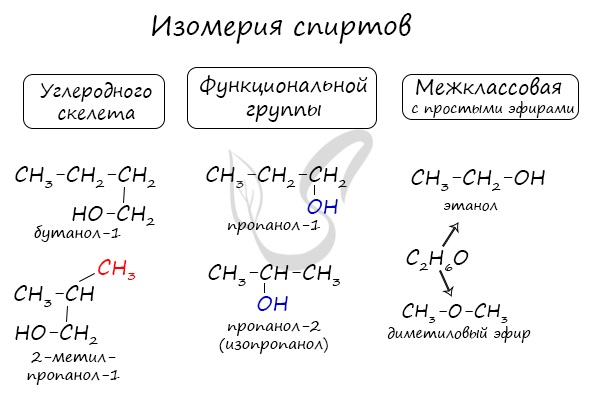
Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье.
Получение спиртов
- Гидролиз галогеналканов водным раствором щелочи
Помните, что в реакциях галогеналканов со сПиртовым раствором щелочи получаются Пи-связи (π-связи) – алкены, а в реакциях с водным раствором щелочи образуются спирты.

Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода.
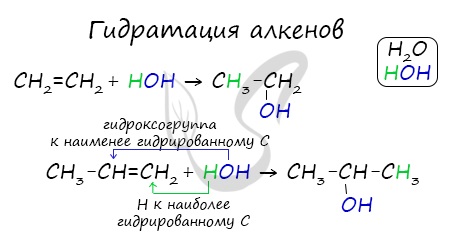
В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты.
Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола.
Получение этанола брожением глюкозы
В ходе брожения глюкозы выделяется углекислый газ и образуется этанол.
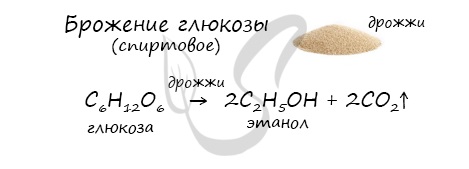
В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы – образуется двухатомный спирт (гликоль).
Химические свойства спиртов
Предельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии – кислотные.
Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д.

Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу.
Реакция с галогеноводородами
Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды.
В результате реакций спиртов с кислотами образуются различные эфиры.

Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента.
Возможен межмолекулярный механизм дегидратации (при t < 140°С), в результате которого образуются простые эфиры. При более высокой температуре (t > 140°С) механизм дегидратации становится внутримолекулярный – образуются алкены.
Названия простых эфиров формируются проще простого – по названию радикалов, входящих в состав эфира. Например:
- Диметиловый эфир – CH3-O-CH3
- Метилэтиловый эфир – CH3-O-C2H5
- Диэтиловый эфир – C2H5-O-C2H5

Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание.
Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции.
Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок.
Первичные спирты окисляются до альдегидов, а вторичные – до кетонов. Альдегиды могут быть окислены далее – до карбоновых кислот, в отличие от кетонов, которые являются “тупиковой ветвью развития” и могут снова стать вторичными спиртами.
Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет.
Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах.
© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Пройдите тест для закрепления знаний
Межклассовыми изомерами предельных одноатомных спиртов являются простые эфиры.
Спирт можно получить реакцией щелочи с галогеналканом в водном растворе.
При внутримолекулярной дегидратации из спиртов образуются алкены.
При нагревании спиртов до 140° преимущественно происходит образование простых эфиров.
Качественная реакция на многоатомные спирты – реакция со свежеприготовленным гидроксидом меди II.
Химическая формула этилового спирта

Алкогольную зависимость можно считать болезнью, которая может появится у любого человека, вне зависимости от возраста. Зависеть это может и не от окружения, наследственности или особенности личности. На сегодняшний есть множество различных проблем связанных с алкогольной зависимостью например: Химическая формула этилового спирта. К счастью есть клиники которые способны помочь с ними справится.
Спирт и алкоголь достаточно плотно вошли в нашу повседневную жизнь. В этой статье будут даны основные рекомендации относительно того, как отличить метиловый от этилового спирта.Также будут указаны их характеристики и химические формулы.
История открытия спирта
Формула спирта в том или ином виде была открыта практически одновременно во многих регионах земного шара.
В 1334 году французский алхимик Арно де Вильггер изначально получил винный спирт. В 1360 году итальянские и французские монастыри производили такое вещество под названием «вода жизни». Генуэзские купцы в 1386 году привезли спирт в Москву, чтобы продемонстрировать его качества.
Определение
Теперь разберемся с тем, что такое этиловый и метиловый спирт.
Метанол (он же метиловый спирт,он же древесный спирт, он же карбинол, он же метилгидрат, он же гидроксид метила) – одноатомный простейший спирт, ядовитая, бесцветная жидкость. С воздухом образует (в объемных концентрациях от 6,98 до 35,5%) взрывоопасные смеси (при температуре 8 градусов по Цельсию). Молекулярная формула спирта метилового – CH4O или CH3-OH.
Этанол (или же этиловый спирт, или же винный спирт, или же алкоголь, в простонародье просто «спирт», метилкарбинол) — спирт одноатомный с привычной формулой C2H5OH. При стандартных условиях это летучая, бесцветная, горючая прозрачная жидкость. Является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека, и действующим компонентом алкогольных напитков.
Сравнение
С позиции определения и химической формулы достаточно просто определить то, как отличить метиловый от этилового спирта. На практике же все не настолько уж и просто.
Если обратится к химии, то можно получить много информации об этих веществах: применении, получении, свойствах, нахождение в природе и т.п. Но давайте вернемся к бытовым вопросам и рассмотрим подробнее, чем отличается метанол от этанола.
Метанол по виду подобен этанолу: бесцветный, с характерным, но более слабым запахом. Это и есть основные свойства метилового спирта. Просто так, к сожалению, эти два вещества очень трудно отличить друг от друга.
Только профессиональный химик сможет визуально отличить один вид от другого. Цвет, запах, вкус настолько схожи, что часто эти вещества путают. Последствия такой путаницы чреваты: от слепоты до летального исхода.
Отличия
В домашних условиях можно провести несложные опыты для выявления отличий. Приведем три важных способа отличия метанола от этанола. Эти же способы будут носить и сравнительный характер.
1 способ. Поджигание исследуемой жидкости. Один из самых простых и надежных способов: поджигаем наш образец, следим за цветом пламени. Этанол горит синим цветом, а метанол – зеленым. Это же так просто и понятно, но помните, что незнание, к сожалению, не освобождает человека от последствий.
Введем новое понятие в нашей статье – технический спирт. Под понятием «технический спирт» понимаем спирты (метанол, денатурат) и их смеси, не пригодные для употребления человеком, наносящие серьезный и непоправимый урон как здоровью, так и жизни.
Также нужно учесть следующий момент: используя градусник в нашем простом опыте, надо зафиксировать температуру закипания, так как известно из разделов химии, что этанол закипает при температуре 78° по Цельсию, а метанол достигает кипения уже при 64°.
2 способ. Используем обыкновенный картофель. Небольшую дольку картофеля на несколько часов нужно бросить в исследуемую жидкость: если по истечении указанного времени картофель не поменял цвет, то перед вами этанол — вещество, пригодное для употребления. Если же долька картофеля окрасилась в розовый цвет, то исследуемая жидкость является метанолом – сильнейшим ядом для организма человека.
3 способ. Формальдегидная проба. Здесь нам понадобится медная проволока, небольшую часть которой необходимо накалить добела и опустить в жидкость. При нахождении в ней этанола можно почувствовать запах прелых яблок, а там, где находится метанол, вы услышите резкий неприятный запах – запах формальдегида.
Помните, что небольшая доза (хватает и 50 мл) метанола может привести к смертельному исходу. Будьте бдительны, не покупайте алкогольные напитки в сомнительных точках продаж, не рискуйте жизнью и здоровьем, а покупайте алкоголь в специализированных магазинах.

Симптомы отравления метанолом
Симптоматика отравления метанолом очень схожа с алкогольным отравлением, но на общем фоне тошноты, головокружения, опьянения, вялости, рвоты, судорог необходимо выделить потерю зрения. Метанол попадает в организм человека во время дыхания, через кожу и пищеварительный тракт.
Возникает сильнейшая боль в ногах, резкая головная боль. Он поражает нервную систему, разрушает сосуды, приводит к слепоте. Быстро всасывается, медленно выделяется, кумулирует (накапливается).
Окисляясь в организме, образует токсичные соединения — муравьиную кислоту и формальдегид. Формальдегид является очень токсичным, так как это вещество первого класса опасности. Он официально признан концерагеном.
Накопление его в организме приводит к развитию онкологических заболеваний. Муравьиная кислота вызывает повреждение глаз и дыхательных путей. Тяжелое отравление с потерей зрения может вызвать прием внутрь всего лишь 5-10 мл метилового спирта.
Смертельная доза находится в пределах от 30 до 100 мл, но она зависит и от индивидуальных особенностей конкретного организма. Смерть наступает от остановки дыхания. Диагноз может быть подтвержден нахождением в моче пострадавшего такого вещества, как муравьиная кислота.
Первая медицинская помощь
Выше было наглядно показано как отличить метиловый от этилового спирта. Однако бывают в жизни такие ситуации, когда приходится оказывать пострадавшему первую медицинскую помощь.
При отравлении метанолом она направлена на выведение из организма яда, задержку процесса окисления данного вещества. Однако в самую первую очередь будет страдать выделительная система. При употреблении технического спирта внутрь, необходимо промыть желудок в течении пары первых часов.
Обычно назначают обильное питье, прием растворов щелочей (гидрокарбоната натрия 10-15 грамм). Противоядием является этиловый спирт, который понижает процесс окисления метилового спирта и образование токсических продуктов превращения. Статистика по случаям отравления метанолом удручающая.
ГОСТ – это прежде всего документ, регламентирующий какими качествами должны обладать товары, продаваемые на территории определенной страны. Существует несколько ГОСТов на этанол, которые описывают предназначение, условия хранения, транспортировки и многое другое.
Но такой сложный вопрос, как употребление алкогольных напитков, может породить многочасовые дебаты.
Да и не в этом дело, ведь каждый человек должен сам для себя решать вопросы подобного уровня. Но давайте обратимся к ГОСТу 1972 года: «Этиловый спирт – легковоспламеняющаяся, бесцветная жидкость с характерным запахом. Относится к сильнодействующим наркотикам, которые вызывают сначала возбуждение, а затем — паралич нервной системы».
Теперь читаем ГОСТ 1982 года: «Этиловый спирт – легковоспламеняющаяся, бесцветная жидкость с характерным запахом, относящаяся к сильнодействующим наркотикам». И, наконец, 2000 год: «Этиловый спирт – это бесцветная, легковоспламеняющаяся жидкость с характерным запахом». Эти же самые нормативные документы и регламентируют такое вещество, как спирт этиловый технический.
Вред и польза алкоголя
Давайте не будем трогать этот огромный айсберг под названием «пить или не пить». Вспомним слова всеми любимого Семена Семеновича Горбункова о пользе алкоголя.
Алкоголь способен незначительно предотвратить формирование тромбов, снизить содержание в крови холестерина, расширить сосуды, что приведет к более интенсивному кровообращению. А лекарство, как известно, любит четкую дозировку, поэтому 50 мл лечит и бодрит. Но польза, которую приносит алкоголь, слишком мала по сравнению с его вредом: алкоголь вносит изменения в генетическую структуру человека, что может привести к отклонениям в умственном развитии потомков, оказывает пагубное действие на нравственное поведение человека.
При этом стоит вспомнить, что именно алкоголь побуждает человека совершать необдуманные, глупые и жестокие поступки. Чтобы такого не случилось, следует четко соблюдать норму. Полезным будет и полный отказ от разнообразных алкогольных напитков.
Помните, что если вы превысите норму, то алкоголь станет ядом, который нанесет вред органам и даже целым системам вашего организма.
Собственно на этом и можно закончить рассуждение о том, как отличить метиловый от этилового спирта.
Разновидности спирта
Алкоголь обладает множеством различных модификаций. Некоторые виды спиртов тесно соприкасаются с пищевыми технологиями, другие являются ядовитыми. Чтобы узнать их действие и влияние на человеческий организм, следует понимать их главные характеристики.
Пищевой (или питьевой)
Или спирт этиловый.
Его получают способом ректификации (процесс разделения многокомпонентных смесей с использованием теплообмена между жидкостью и паром). За сырье для его приготовления берутся различные виды зерен. Химическая формула питьевого этилового спирта следующая: С2Н5ОН.
Пищевой спирт, входящий в состав алкоголя, воспринимается в большинстве случаев, как водка. Именно им и злоупотребляют многие личности, доведя себя до стойкой алкогольной зависимости.
Пищевой этанол обладает и собственными разновидностями (они зависят от видов сырья, которое было использовано). Классификация питьевого спирта имеет следующие виды:

Спирт I сорта (или медицинский)
Его не используют для выпуска алкогольной продукции. Данное соединение предназначено для использования исключительно в медицинских целях в качестве антисептика, обеззараживания операционных и хирургических инструментов.
Альфа
Спиртовое соединение высшего сорта.
Для его изготовления берется отборная высококачественная пшеница или рожь. Именно на базе спирта Альфа выпускается элитные алкогольные напитки суперпремиум класса.
Для производства питьевого этанола данного уровня используют картофель и зерно, с учетом, что на выходе объем картофельного крахмала не должно превышать 35%.
Спиртовое соединение пропускается через несколько ступеней фильтрации. Из него выпускают водку премиум-класса. Данные водочные напитки обладают несколькими степенями защиты. У них особенная форма бутыли, специально разработанные голограммы, уникальный колпачок.
Экстра
На его основе делают классическую и многим знакомую водку среднеценового сегмента.
Данный питьевой спирт разбавляют (его крепость в неразбавленном виде составляет около 95%) и плюс ко всему подвергают дополнительной очистке. Итоговая продукция обладает меньшим содержанием сложных эфиров и метанола. Алкоголь на базе данного соединения считается экологически чистым продуктом, правда, не таким дорогим, как спиртное на базе Альфа либо Люкса.
Базис
Практически не уступает водочным этанолам Экстра и Альфа.
Обладает такой же высокой крепостью (порядка 95%). Водка, изготовленная из этого питьевого спирта, является самым ходовым товаром, так как она наиболее доступна (средний ценовой сегмент рынка). Производят спирт этой марки из картофеля и зерна, с учетом, что объем картофельного крахмала в получаемой продукции не превышает 60%.
Спирт высшей категории очистки
Изготавливают его на базе смеси следующих продуктов:
Данное соединение при технологическом процессе подвергается минимальной обработке и отфильтровыванию от различных примесей и сивушных масел. Его пускают на изготовление дешевой водки экономкласса, различных настоек и ликеров.
Способы использования этанола
Этиловый спирт используется не только в любимой многими алкогольной индустрии. Его применение разнообразно и довольно любопытно. Кстати, этиловый спирт используется и в качестве антидота при отравлении метанолом. Это эффективное противоядие в случае интоксикации техническим спиртом.
В этом случае следует немедленно звонить в Скорую помощь. Помните, что при неоказании квалифицированной помощи очень велик риск летального исхода.
Подводя итоги, можно понять, что уметь разбираться в видах спирта и отличать ядовитое соединение от питьевого этанола очень важно. Не забывайте, что даже при потреблении мизерного количества ядовитого метанола, вы подвергаете свою жизнь риску и подводите свой организм к фатальной смертельной черте.
Данная проблема: Химическая формула этилового спирта, достаточно популярна на сегодняшний день. Алкоголь может действовать на людей по-разному. Возможно алкоголь и приносит какую то пользу, но чаще всего употребление спиртных напитков пагубны для здоровья. Самым сложным с чем приходится справляться это психологическая зависимость, в этом случае нередко приходится обращаться за помощью.
Урок 22. Спирты

Определение
Спирты — это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксогруппу ОН.
Если углеводородный радикал обозначить буквой R, то в общем виде формулу молекулы спирта можно изобразить так:
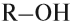
У атома углерода, который соединен с гидроксогруппой, все связи должны быть простыми:
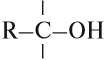
Соединения, у которых гидроксогруппа находится рядом с двойной связью, неустойчивы:
По строению углеводородного радикала спирты делят на:
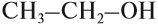
в углеводородном радикале, все связи простые;
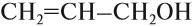
в углеводородном радикале, есть кратная связь;
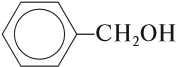
имеется бензольное кольцо, т. е. в углеводородном радикале есть ароматическая связь.
По числу гидроксогрупп спирты делят на:
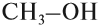
в состав молекулы входит одна гидроксогруппа ОН;
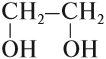
в состав молекул входит две или более (много) гидроксогрупп.
Рассмотрим строение молекул и свойства предельных одноатомных спиртов.

Гомологический ряд, номенклатура, изомерия
Для того чтобы вывести общую формулу гомологического ряда предельных одноатомных спиртов, сравним их состав и состав алканов:
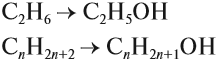
В названиях спиртов гидроксогруппа обозначается суффиксом ОЛ. Этот суффикс прибавляется к названию исходного углеводорода:
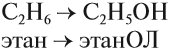
Кроме этих названий (по ИЮПАК) для простейших спиртов используют рациональные названия, которые происходят от названия радикала:

Начиная с n = 3, для спиртов возможна изомерия. Она связана с положением группы ОН в молекуле:

Вопрос. Как обозначить положение группы ОН в молекуле?
Как всегда, положение группы ОН обозначают цифрой, которая соответствует номеру атома углерода, соединённому с группой ОН. Нумерацию основной цепи начинают с того конца, к которому ближе группа ОН.
Таким образом: название спирта (1) пропанол-1; название спирта (2) пропанол-2.
Поскольку спирты называют «по радикалам», эти спирты можно назвать и так: пропиловый спирт (1) и изопропиловый спирт (2).
Задание 22.1. Составьте молекулярные формулы этих спиртов и убедитесь, что это — изомеры.
Спирты изомерны простым эфирам, в молекулах которых атом кислорода соединяет два углеродных радикала (это изомерия между разными классами веществ):

Простые эфиры — это вещества, в молекулах которых два радикала соединены атомом кислорода. Поэтому их называют, исходя из названий радикалов. Например, простой эфир (3) — это диметиловый эфир.
Задание 22.2. Составьте графическую формулу изомера пропиловых спиртов, который является простым эфиром. Назовите его.

Строение молекул
Если при помощи графической формулы показать строение молекулы этилового спирта, то легко можно увидеть, что атомы водорода в ней неравноценны:
Действительно, пять атомов водорода соединены с атомами углерода, а один — с атомом кислорода. Теория Бутлерова утверждает, что «атомы в молекуле взаимно влияют друг на друга». Поэтому можно ожидать, что этот атом водорода будет отличаться от остальных пяти. Это отличие заключается в том, что связь О–Н гораздо более полярна, чем связи С–Н. Дело в том, что атом кислорода имеет бОльшую электроотрицательность, чем атом углерода, т. е. способен сильнее смещать к себе общую пару электронов. В результате, на атомах кислорода и водорода связи О–Н появляются значительные заряды (+) и (–).
Вопрос. На каком атоме появляется (+), а на каком (–)?
Величина этих зарядов меньше единицы, но они способны притягивать к себе молекулы других реагирующих веществ, т. е. активнее участвовать в химических реакциях будут наиболее полярные связи.
Вывод. Самыми полярными связями в молекуле спирта являются связи О–Н и О–С. За счёт их разрыва происходят химические реакции (спирт функционирует). Поэтому ОH — функциональная группа спиртов.

Свойства одноатомных спиртов
Физические свойства
Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с т. кип. 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).
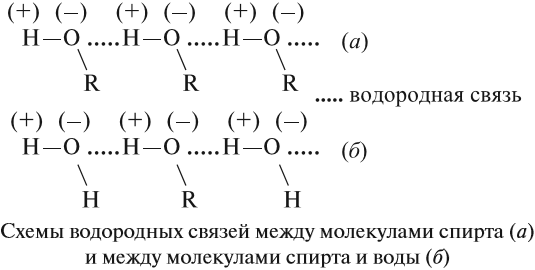
Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом.
Химические свойства
Спирты могут реагировать с натрием и другими щелочными металлами. При этом атом водорода ОН-группы замещается на атом металла:
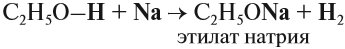
Вопрос. Неорганические вещества какого класса способны вступать в реакции замещения с металлами, в результате чего выделяется водород?
Аналогичную реакцию дают кислоты, поэтому в этой реакции спирт проявляет кислотные свойства. Но это очень слабые свойства, так как растворы спиртов не изменяют окраску индикаторов и не реагируют с растворами щелочей.
Спирты реагируют с неорганическими кислотами:
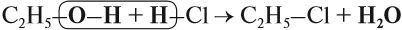
В этой реакции отщепляется молекула воды, — значит, это реакция дегидратации. При записи таких реакций формулы исходных веществ записывайте так, чтобы функциональные группы были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга. Так, в результате реакции дегидратации, в которой участвуют две молекулы спирта, образуется простой эфир (дегидратация межмолекулярная):
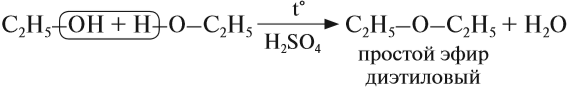
Эта реакция происходит в присутствии концентрированной серной кислоты. Если смесь спирта и концентрированной серной кислоты нагреть сильнее, то молекула воды отщепляется от одной молекулы спирта (дегидратация внутримолекулярная):
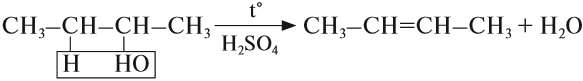
Спирты, у которых ОН-группа соединена с первым (последним) атомом углерода углеродной цепочки (первичные спирты) легко окисляются нагретым оксидом меди CuO, превращаясь в альдегиды:
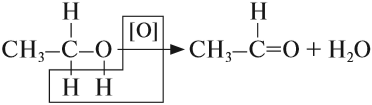
При составлении этой реакции рекомендуется выделить (подчеркнуть) те атомы, которые образуют воду, и записать новую формулу без этих атомов. Спирты горят, образуя, как и углеводороды, углекислый газ и воду.
Задание 22.3. Составьте уравнение реакции горения этилового спирта.
Таким образом, для спиртов характерны реакции:
- замещения атома водорода ОН-группы;
- дегидратации (отщепления воды);
- окисления.
Все эти реакции идут с участием ОН-группы функциональной группы спиртов.
Задание 22.4. Составьте уравнения таких реакций для пропанола-1 (пропилового спирта). Уравнения реакций составляйте по аналогии с вышеперечисленными.
Получение и применение спиртов (на примере этилового спирта)
Этанол и другие спирты можно получить из алкенов.
Вопрос. При помощи какой реакции можно это осуществить (при затруднении см. урок 19.3)?
Задание 22.5. Составьте уравнение этой реакции.
Полученный таким способом спирт используют в технических целях: в качестве растворителя, для получения каучука, пластмасс и др. Кроме того, спирт используют как горючее.
Пищевой и медицинский спирты получают брожением глюкозы:
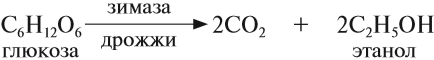
В лаборатории этиловый спирт можно получить гидролизом (взаимодействием с водой) хлорэтана:
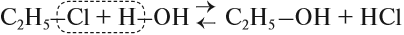
Для того чтобы эта реакция стала необратимой, используют водный раствор щёлочи.
Задание 22.6. Составьте уравнения реакций:
- пропен + вода;
- 1-хлорпропан + NaOH (водный).
Назовите полученные вещества.

Многоатомные спирты
Многоатомные спирты содержат две и более гидроксогруппы в молекуле. При этом каждый атом углерода в молекулах спиртов может соединяться только с одной гидроксогруппой ОН, в противном случае образуются неустойчивые соединения:
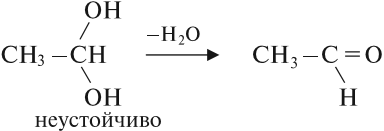
Задание 22.7. Составьте формулы многоатомных спиртов, в молекуле которых:
- два атома углерода и две гидроксогруппы;
- три атома углерода и три гидроксогруппы.
У вас получились формулы простейших многоатомных спиртов:

Вопрос. Как в названии спирта обозначить число гидроксогрупп?
Названия по IUPAC этих спиртов составляют, используя уже известные правила, т. е. к названию углеводорода добавляют суффикс ОЛ, а перед ним указывают число ОН-групп при помощи префиксов ди- или три-. Например, этиленгликоль получит название: этандиол.
Задание 22.8. Назовите по правилам IUPAC глицерин.
Вопрос. Как вы считаете, какой из спиртов будет иметь большую температуру кипения — глицерин или пропанол-1? А растворимость в воде?
Многоатомные спирты за счёт многочисленных ОН-групп образуют многочисленные водородные связи и друг с другом, и с водой. Поэтому они имеют бОльшие температуры кипения и бОльшую растворимость в воде по сравнению с соответствующими одноатомными спиртами. Так, глицерин — бесцветная, густая жидкость, без запаха; он смешивается с водой в любых соотношениях и способен поглощать влагу из воздуха. Более того, безводный глицерин может отнимать воду из живых клеток кожи, вызывая ожоги. Растворы глицерина, наоборот, смягчают кожу.
Химические свойства глицерина и других многоатомных спиртов очень похожи на свойства одноатомных спиртов: они реагируют с натрием и НСl, образуют эфиры, могут окисляться. Например, глицерин реагирует с азотной кислотой:
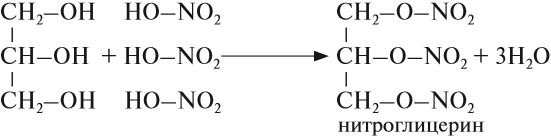
Нитроглицерин входит в состав сильнейшей взрывчатой смеси динамита. Его раствор используется как лекарство.
Но в химических свойствах многоатомных спиртов есть и существенные отличия. Так, они могут растворять осадок гидроксида меди II, образуя ярко-синий раствор:
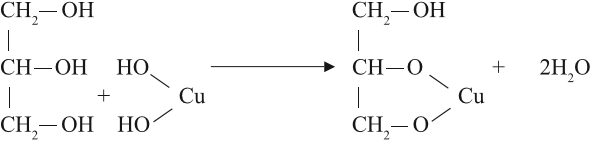
Реакция происходит при обычных условиях, причём полученное соединение очень прочное: не изменяет свой цвет даже при кипячении. Одноатомные спирты такую реакцию не дают.
Вывод. Реакция растворения голубого осадка гидроксида меди II с образованием ярко-синего раствора — это качественная реакция на многоатомные спирты.
Задание 22.9. Составьте уравнения реакций этиленгликоля:
Подсказка. При составлении уравнений этих реакций записывайте формулы многоатомных спиртов так, чтобы цепочки атомов углерода располагались вертикально, а группы ОН были рядом, причём атомы водорода функциональных групп ОН «смотрели» друг на друга.
Глицерин находит широкое применение в кожевенной промышленности (смягчает кожу), используется в медицине, входит в состав невысыхающих красок. Кроме того, глицерин, точнее, остаток его молекулы входит в состав любого жира. Поэтому глицерин часто получают из природных жиров (уравнение реакции в уроке 25).

Понятие о фенолах
К фенолам относятся вещества, в молекулах которых гидроксогруппа ОН непосредственно связана с бензольным кольцом:
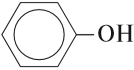
В этой молекуле ОН-группа и бензольное кольцо взаимно влияют друг на друга. Поэтому фенол по свойствам отличается и от спиртов, и от бензола. Рассмотрим примеры такого влияния.
Бензольное кольцо влияет на ОН-группу, делая её более полярной, чем у спиртов. Поэтому фенол, в отличие от спиртов, реагирует с растворами щелочей:
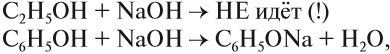
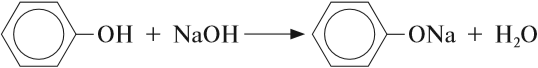
В данной реакции фенол проявляет свойства кислоты. Отсюда его второе название — карболовая кислота («карболка»). Растворы фенола изменяют окраску индикатора.
Гидроксогруппа влияет на бензольное кольцо. Фенол очень легко вступает в реакции замещения, причём, как и для толуола, реакция происходит в положениях 2, 4, 6 по отношению к гидроксогруппе:
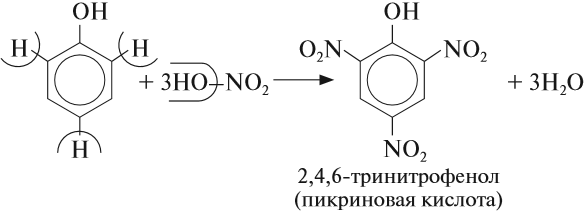
В отличие от спиртов и бензола фенол обесцвечивает бромную воду даже при нормальных условиях. Реакция протекает аналогично предыдущей.
Задание 22.9. Составьте уравнение реакции фенола с бромом и сравните эту реакцию с реакцией толуола с бромом.
Фенол легко окисляется на воздухе, при этом его белые кристаллы розовеют. Фенол сильно ядовит, так как изменяет структуру и свойства белков — основу всего живого. Кроме того, попадая в воду, он окисляется растворённым в ней кислородом. В результате содержание кислорода в водоёме уменьшается, и обитатели его погибают. Для того чтобы обнаружить фенол в водоёме и любом растворе, используют качественную реакцию с FeCl3: при добавлении этого реактива к смеси, содержащей фенол, появляется фиолетовое окрашивание.
Фенол получают из производных бензола и каменноугольной смолы. В любом случае вначале исходное вещество или смесь превращают в фенолят, а затем выделяют чистый фенол при помощи кислоты:

Фенол применяют для дезинфекции и получения красителей и полимеров.

Выводы
Спирты и фенолы — это производные углеводородов, содержащие функциональную группу ОН. Для таких веществ характерны реакции замещения атома водорода в гидроксогруппе.
Спирты за счёт функциональной группы ОН образуют простые и сложные эфиры (см. урок 25), а фенолы реагируют и за счёт функциональной группы ОН, и за счёт ароматического ядра.
Формула спирта в химии
Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на
o одноатомные (одна группа -ОН)
o многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов – полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
трехатомный спирт – глицерин (пропантриол-1,2,3)
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
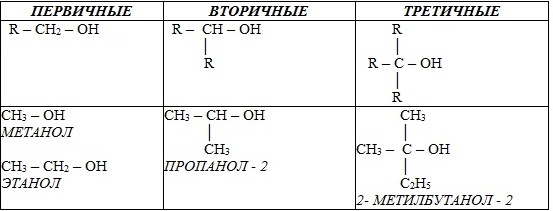
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны.
Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (- OH )
2. Гомологический ряд
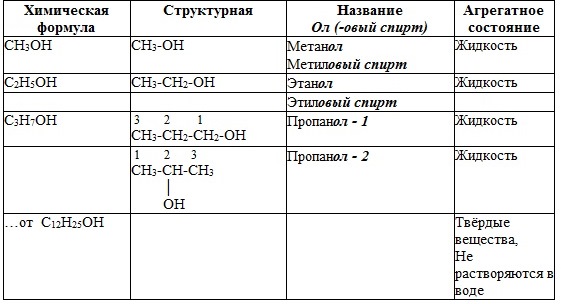
Метиловый спирт
(метанол)

Этиловый спирт
(этанол)

3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:

Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса “ол”.

По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова “спирт“. В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
Для спиртов характерна структурная изомерия:
· изомерия положения ОН-группы (начиная с С3);
Например:

· углеродного скелета (начиная с С4);
Например, изомеры углеродного скелета для C4H9OH:

· межклассовая изомерия с простыми эфирами
Например,
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3 C H(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:


Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более “кислым” в ряду одноатомных предельных спиртов будет метиловый (метанол).
Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.








